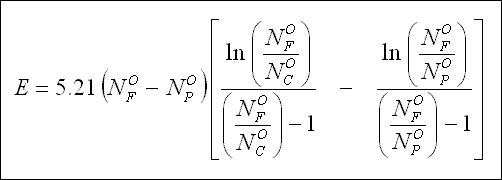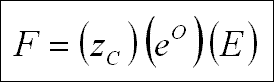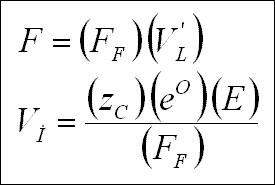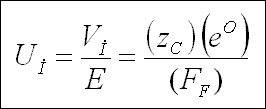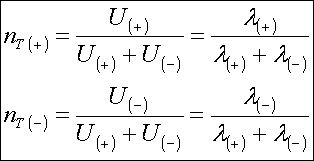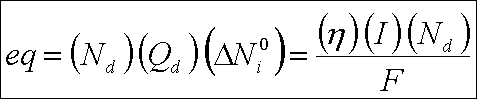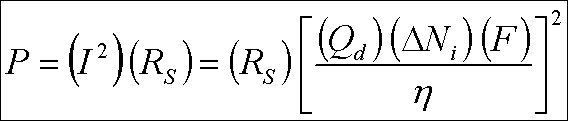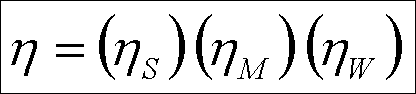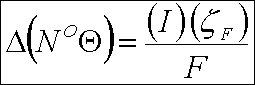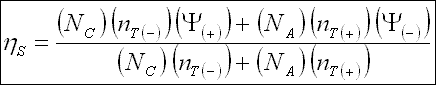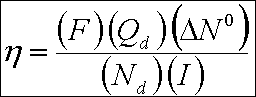Türkçe metni rahat izleyebilmeniz için, "browser" ınızın "document encoding" ini "Turkish" olarak değiştirdiniz mi ? ...
İleri ( Üçüncül ) Arıtma Yöntemleri - 3...

Elektrodiyaliz - 2...
Yazar : Ayşegül İyilikçi...
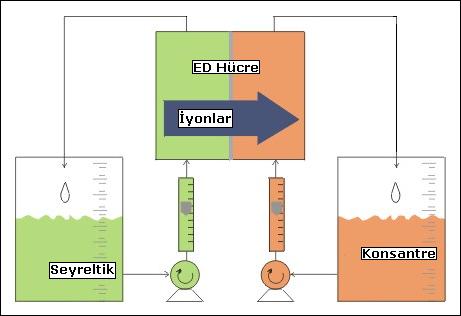
Elektrodiyaliz işleminde elektrik akımı iyonik bir çözelti içindeki bileşenlerin ayrılmasına neden olur. Ayırma işlemi
akım yönü karşısına anyon ve katyon seçici membranların sıralı olarak yerleştirilmesi ile oluşur. Akım uygulandığında,
elektriksel olarak yüklenmiş katyonlar bir yöndeki katyon değiştirici membran içinden geçer, anyonlar ise diğer yöndeki
anyon değiştirici membran içinden geçerler. Sonuçta, birbirini izleyenj boşluklar içindeki membranlar arasında bir boşlukta
tuzluluk artar diğerinde ise azalır. Bu olay, paralel membranların tüm kümelerinde oluşur. Böylece su istenen tuzluluk
kalitesi elde edilinceye böyle bir çok kümeden geçirilir. " Schwein " ve " Svedberg "e göre, muhtemelen 1900 yılları
civarında şeker ekstratlarını saflaştırma işleminde ilk olarak kullanılmıştır. Bununla birlikte, " Morse " ve " Pierce "
elektrodiyaliz işlemini ilk olarak 1903 yılında geliştirmişlerdir. Bir laboratuvar dializinin daha iç ve daha dış kısmındaki
bölümlerine elektrodları yerleştirmişler ve bir akım yüklemek sureti ile jelatinden elektrolitik kirliliklerin daha hızlı
giderildiğini görmüşlerdir. " Pauli " 1924 yılında, konsantrasyon polarizasyonunu minimuma indirgeyen mühendislik tasarım
prensiplerini uygulamıştır. İlk yapılan cihazlarda membranlar seçici değildi ve tuzluluğu azaltılmış kompartmanlara ters
yönde difüzyon sorunu yaratıyorlardı. İyon seçici membranların geliştirilmesi, uygun bir akım ile, konsantrasyon gradyanına
karşı membran kümelerinin işletilmesini uygulanabilir yapmıştır. Nötral membran ile yapılan işlemde, ya anyon ya da katyon
seçici membranlar yerine seçici olmayan bir membran kullanılır. Elektrogravitasyon ( elektrodekantasyon olarak da bilinir )
işleminde hücre boşluğu büyüktür ( 0.5 - 1.0 cm ). Arıtılmış kısım hücrenin üst kısmından dışarı alınır, konsantre olmuş
kısım ise alt taraftan alınır.
Minimum Enerji Gereksinimleri...
" Spiegler " termodinamik yasalarını kullanarak elektrodiyaliz işlemi için gerekli olan minimum enerji miktarını, E,
aşağıdaki denklem ile tanımlamıştır ;
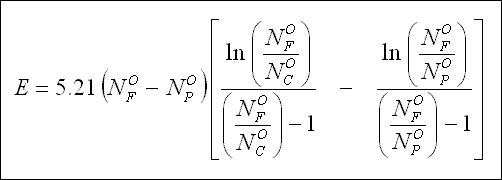
Bu denklemde, N, ekivalent / L olarak ifade edilen iyonik türlerin konsantrasyonudur. Alt indisler, ana akıma, arıtılmış
akıma ve konsantre akıma aittir. E, çoğunlukla kWh / 1,000 galon ürün için verilir. Bu denklem, elektrod reaksiyon güücünü
ihmel eder ve sadece ana akımın, tuzlu ve arıtılmış akımın serbest enerjilerini dikkate alır. Polarizasyon, hücre direnci
ve akım verimlerinin % 100'den az olmasından dolayı güç tüketimi aslında, yukarıdaki denklem ile elde edilenden daima daha
fazladır. İyi tasarımlanmış elektrodiyaliz hücresindeki gerçek enerji gereksinimi, teorik değerden 10 ila 20 kat daha
fazladır. Hem teorik hem de uygulamada, besleme suyunun tuzluluğunun artması ile enerji gereksinimi de artar.
Seçici İyon Taşınımı...
Elektrolit bir çözelti üzerine elektrik bir alan, E, empoze edilirse, iyonlar bir F kuvveti taşırlar.
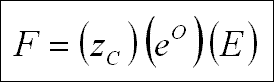
Bu denklemde ; e O : elektronik yük ve z C : iyonik türlerin değerliği. Elektrik alanı, E, iyonları
ya anoda ya da katoda doğru biriktirir. z C 'nin işaretine bağlı olarak, akışkanı çevreleyen moleküller, iyon
hızını sınırlayan ters bir sürükleme kuvveti, F F oluştururlar.
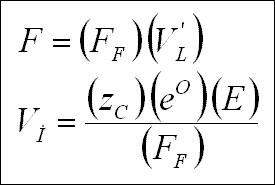
İyonun mobilitesi, Uİ, birim alan başına hız olarak tanımlanır ve aşağıdaki denklem ile verilir ;
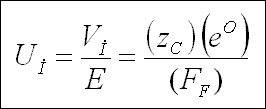
" Ohm " kanununun uygulanması ile ve bir gram eşdeğer iyonun saniye başına hareketinin 96,493 kulon, yani bir " Faraday "
gerektirdiği kabulü ile, mobilite ile eşdeğer iletkenlik türetilebilir ;

( - ) ve ( + ) indisler iyonik türlerin yük işaretleridir. İyonik mobiliteler belli bir iyonla taşınan toplam akımın
fraksiyonu olan nT taşıma sayısının belirlenmesinde kullanılırlar ;
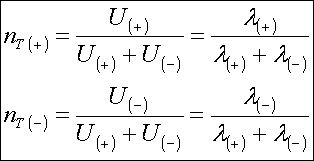
Elektronötralite ise ;
nT ( + ) + nT ( - ) = 1
denklemi ile tanımlanır. Bir elektrodiyaliz çözeltisi içindeki mevcut bir iyonun taşıma sayısı bir çözelti içindekinden
membran içinde daha farklıdır. Bir elektrik akımının geçişi, membranın bir tarafı üzerinde konsantre olmuş bir tabakanın
oluşumuna, diğer tarafta ise seyrelmiş bir tabakanın oluşmasına neden olur. İyon değiştirici yarı - seçici membranların
temel teorisi, membranların kolaylıkla yayılan iyonlar içerdiğini, zıt yüklü sabit gruplarca serbestçe sınırlandığını
ortaya koymuştur. Eğer sabit gruplar anyonik ise ve hareketli iyonlar veya ters yüklü iyonlar katyonikse katyonlar,
elektriksel bir alan oluştuğunda tercihli olarak membrandan geçerler. Sabitleştirilmiş katyonik gruplar ve hareketli
anyonlar membrana anyonik permeabilite vereceklerdir. Aşağıdaki şekilde bir membrana karşı iyon taşınımı şematize
edilmiştir ;
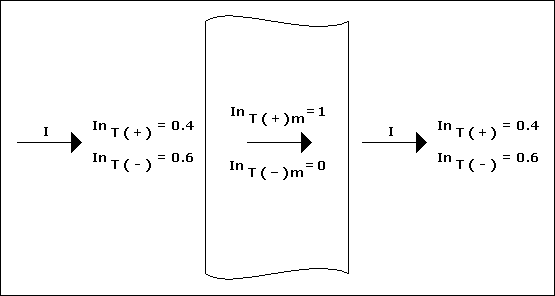
nT ( + ) = 0.4 ve nT ( - ) = 0.6 olduğunda membran sadece pozitif yüklü iyonları geçirecektir.
Membranın sol tarafındaki elektrik akımı membran yüzeyine ( nT ( + ) ) ( I ) / F hızı ile elektrik akımını
taşır. Burada I akımdır ve iyonlar membran karşısına ( nT ( + ) m ) ( I ) / F hızı ile taşınırlar. Benzer
şekilde negatif iyonlar da komşu ara yüzeyinden membranın sol tarafındaki yüklü çözeltiye ( nT ( - ) m )
( I ) / F hızında transfer olurlar. Bu iyonlar yenilenemezler, çünkü taşınma sayısı sıfırdır. Eğer geriye doğru bir
difüzyon yoksa, bir " Faraday "lık elektrik membran karşısına 0.6 eşdeğer tuz taşıyacaktır. Benzer bir şekil anyon seçici
membranlar için de çizilebilir.
Membran Özellikleri ve Hazırlanması...
İyi bir elektrodiyaliz membran ters olarak yüklenmiş iyonlar arasında ayırım yapabilmeli ve iyi bir elektriksel
iletkenliğe sahip olabilmelidir. Ayrıca, iyi bir kimyasal mukavemete ( özellikle oksidasyona ), mekanik basınca ve
boyutsal stabiliteye sahip olmalıdır.
Konsantrasyon Polarizasyonu...
Ters osmoz ve ultrafiltrasyonda olduğu gibi, konsantrasyon polarizasyonu elektrodiyaliz işleminde de önemli bir faktördür.
Kararlı durumda, iyon değişimi membran ara yüzeyinde tuzun hareketleri ile dengelenir. Tuz, erimiş maddelerin moleküler
ve " Eddy " difüzyonu ile membrana taşınır. Giderimi, elektrik akımı ve ara yüzeyde taşınım sayısı farkına bağlıdır.
Katyon geçirgen membranlar için bu etkiler, sınır tabaka konsantrasyon gradyanı ile aşağıdaki gibi bulunabilir ;

Eğer C İM yaklaşık 0 ise akım yoğunluğu bir sınır değere yaklaşır ;

Polarizasyon, ekonomik optimizasyona göre, genellikle elektrodiyaliz kümeleri içindeki akım yoğunluğunu sınırlayan bir
unsurdur.
Güç ve Enerji Gereksinimi...
Güç gereksinimi tuz giderim hızının bir fonksiyonudur ve " Ohm " ve " Faraday " kanunları ile hesaplanır. " Faraday "
kanunu, elektrik akımı ile membran içine elektrolit transferini saptamak için kullanılır.
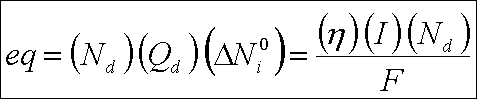
Burada ; eq : birim zamanda taşınan ekivalent, N d : seyrilmiş akım bölümlerinin sayısı, Q d :
seyrelmiş akım bölümü içine olan hacimsel akım hızı, I : akım, İTA : akım verimi, F : " Faraday " sabiti ve
N İ O : birim hacim başına elektrokimyasal eşdeğer gram sayısı.
Demineralizasyon için belli bir membran kapasitesi ; akıma, membran çifti sayısına ve akım verimine bağlıdır. " Ohm "
kanununa göre, gerekli güç şu şekilde ifade edilir ;
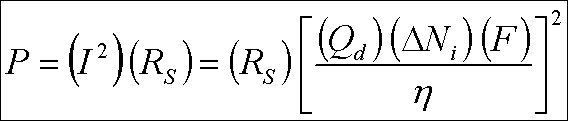
Burada ; R S : membran kümenin elektriksel mukavemeti. Bu denklem, birim eşdeğer demineralizasyon başına
enerjinin akımla doğru orantılı olarak arttığını, güç gereksiniminin de akımın karesi ile arttığını gösterir. Enerji
gereksinimi aşağıdaki denklem ile ifade edilebilir ;
 Akım Verimi...
Aşağıdaki faktörler nedeni ile, elektrodiyaliz sistemlerinde akım gereksinimi teorik değerden daha fazladır.
Akım Verimi...
Aşağıdaki faktörler nedeni ile, elektrodiyaliz sistemlerinde akım gereksinimi teorik değerden daha fazladır.
( a ) Membranlar mükemmel seçici değildir.
( b ) Paralel akım yolları küme içinde kurulmuştur.
( c ) Su membran karşısına taşınabilir
( d ) Su H + ve OH - 'ye yüksek akım yoğunlukları veya düşük tuz konsantrasyonlarında
ayrılabilir.
Akım verimi üç verimliliğe bağlıdır ;
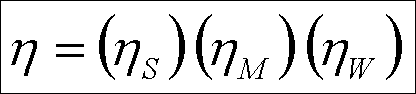
Burada ; İTA S : minimum mükemmel membran seçiciliği, İTA M : akım sızmasının değişimi
( % 95'ten büyüktür ) ve İTA W : membrana su taşınımı.
Elektrodiyaliz kümesinde seyrelmiş akımdan giderilen tuz miktarı, membranların sayısının ve çözelti ile membran arasında
taşınım sayısı farklarının bir fonksiyonudur. " Faraday " kullanım faktörü ile net tuz giderimini ( birim akım başına )
bulmak olasıdır ;

Burada ; N C : katyon membran sayısı ve N A : anyon membran sayısı.
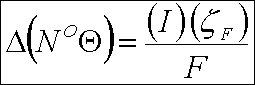
Anyon ve katyon kümesi içine akımla taşınan tuzun verimi ise ;
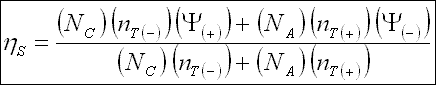
" Shaffer " ve " Mintz "e göre, akım verimine su taşınımının katkısı ;

Burada ; n T ( W ) m : membran içine su taşınım sayısı ve N F O : birim hacim başına
eşdeğerdeki besleme suyu konsantrasyonu.
Akım verimi, hücre kümeleri konusunda genellikle amprik olarak verilir ;
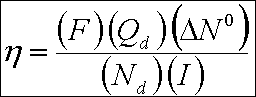
Bu denklem, akım veriminin küme mukavemeti voltaj veya küme düzenlemesine bağlı olmadığını gösterir.
Aşağıdaki " Word " belgesi ile devam ediniz...